日: September 2020
生物発光イメージング(BLI)は非侵襲的な光学画像化手法で、組織内の生物発光シグナルを視覚化、定量化することができます1。そのしくみは、In vivo で酵素が分子レポーターとして発現する際にその酵素を介して基質が酸化し生成される光を検出するというものです。
従来の画像化や生体内分布研究では、最終エンドポイントをはじめ、侵襲的な手順、放射性標識を用いたりしますが、BLI はそれに代わる堅牢で高感度かつ高能率な手法と言えます。 We were the first CRO to offer BLI in 2003 and in the 17 years since we have amassed considerable experience and know-how in this optical imaging field.このテクノロジースポットライトでは、生物発光イメージングの原理をご紹介するとともに、この臨床サービスが、癌の検出、病態の進行のモニタリング、In vivo での抗腫瘍効果評価にとってどのようなメリットがあるのかご説明したいと思います。
まず、 BLI ではルシフェラーゼを発現させるための細胞が必要です。ルシフェラーゼ は、ルシファーというラテン語から派生した言葉で、明けの明星、光をもたらすものといった意味を持ち、ホタルやシーパンジーなどがこのルシフェラーゼを産生します。ホタルの Luc 遺伝子が初めてクローン化されたのが 1985年2。それ以来、蛍光カラーでの画像化にはグリーン(緑)が最もよく使用されています。ホタルのルシフェラーゼの使用にあたっては、その基質 D-ルシフェリンを注入しなければなりません。D-ルシフェリンが、562 nmでピークになる生物発光シグナルを生成し、それを遮光キャビネット内に取り付けた高量子効率の電荷結合素子(CCD)カメラで捉えます。 The sequence of events leading from engineering tumor cells to express luciferase to imaging animals in vivo is illustrated in Figure 1. We use IVIS® In Vivo Imaging Systems (PerkinElmer, Waltham, MA) which allow high sensitivity and high resolution in vivo BLI and fluorescence imaging (FLI) across a wide range of wavelengths.このシステムでは 2% のイソフルランガス麻酔を施した動物最大 5 体の同時撮影が可能。各個体に D-ルシフェリンを注射し、10〜15 分後に画像化を行います。BLI のシグナルは、腫瘍周辺、特定の部位(頭蓋、胸部、腹部など)、全身、Ex vivo の組織など関心領域(ROI)で定量化して、1秒あたりの光子数で表示。これはユーザー定義領域から全方向への放射流束を表します。そしてソフトウェア Living Image 4.3.1(PerkinElmer 社、マサチューセッツ州ウォルサム)を使用して画像を分析します。
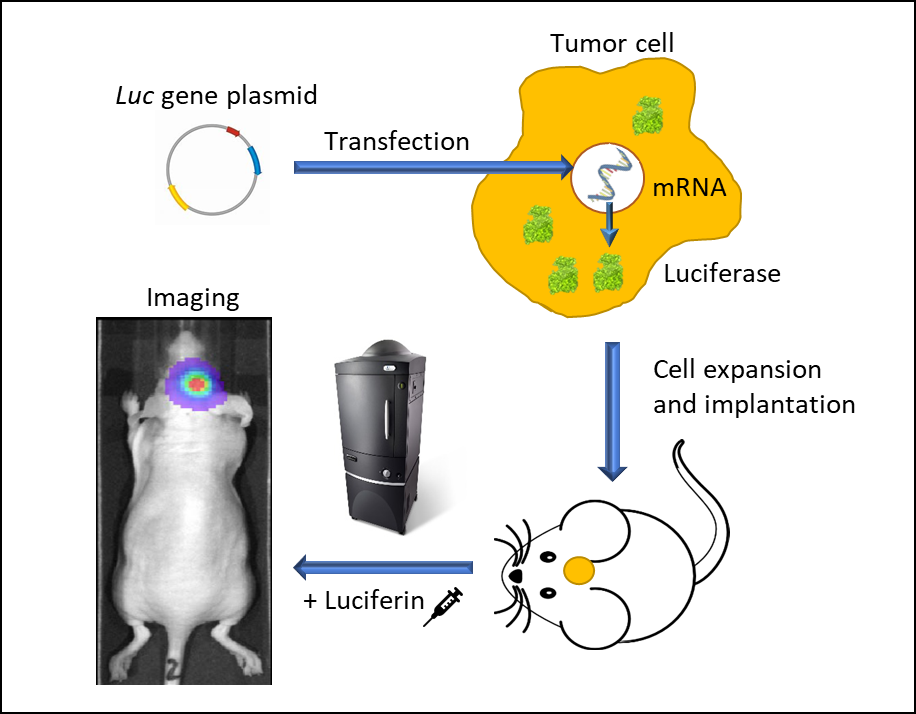
図 1:発光性の生細胞を利用した In vivo 生物発光イメージング。プロモーター駆動型 Luc 遺伝子を持つベクターを腫瘍細胞にしっかりと導入し、 それを増殖させてマウスに移植する。腫瘍が増殖した後、マウス個体にルシフェリンを注射し、麻酔下で IVIS イメージングシステムを使用して画像撮影。すると発光する Luc 細胞を空間的・空間的に捉えることができる。
同所性固形腫瘍の増殖のモニタリング
効果、感度ともに優れた BLI の手法とツールは、この 20年で応用の幅がこれまでになく広がりました。その範囲は、タンパク質間相互作用、遺伝子スクリーニング、細胞周期調節因子、寄生虫感染症、幹細胞の生着追跡、NK 細胞遊走などの研究、さらには前臨床のオンコロジー研究にまで及びます。数々の研究がなされた結果、BLI イメージングによって腫瘍の発達状況を一時的に評価できることが分かりました3。このことは、腫瘍の成長をキャリパーで測定・決定することができず、体重減少などの臨床症状や安楽死後の腫瘍量評価などに依存しなければならないケースでは特に大きな意味を持ちます。以下は、IACUC のプロトコルの審査・承認を受けている AAALAC 認定施設で動物倫理の規制に従って動物のケアおよび使用を実践した時の例です。
図 2 には、非侵襲的な BLI が深部組織で発達する腫瘍をモニタリングするのに有用であることがよく現れています。図 2 左上は、NCI-H460-Luc2 ヒト肺癌異種移植片をメスのヌードマウスの左肺に同所(OT)移植(1 個体あたり細胞 1x105 個)した時のもので、 BLI の画像は、腫瘍細胞移植後 8 日目という早さで胸腔に腫瘍が検出されたこと(28日目に見られた最大シグナルに合わせて閾値処理をしたため図では確認不可)、そして腫瘍量がその後 2 週間で増加したことを示しています。マウスの体重は研究期間全体で平均 18.3 %減少し(疾患に関連していると考えられる。図なし。)、腫瘍細胞移植から 28 日後に安楽死処置が行われました。剖検では、原発腫瘍が著しく増殖し胸腔全体に腫瘤がかなり発達していることが明らかになっています。図 2 左下は、メスのアルビノ C57BL/6 マウスに GL261-luc2 同系マウス神経膠腫細胞(1 個体あたり細胞 1x106 個)を頭蓋内に移植した時のものです。移植 7 日後に脳内で腫瘍を検出。このモデルでは病態の進行に関連する体重減少が全体的に見られ、それが腫瘍移植 11 日後から数値に現れました。死亡までの時間は平均約 21 日でした。 さらに図 2 右上と右下は、ヒト乳腺癌細胞株 MDA-MB-231-luc-D3H2LN をメスのヌードマウスの心臓内に注入(1 個体あたり細胞 1x105 個)して骨病変が形成されたところを捉えたものです。 骨病変は、腫瘍細胞注入の 21 日後からはっきりと見えるようになり、その後 3 週間で腫瘍の数と総量がともに増加しました。マウスの体重は 32日目までに最大 16.2 %減少しています。体重減少はモデルの攻撃性に大きく関係していました(図なし)。いずれにしてもこれらの研究から、BLI がさまざまな腫瘍をリアルタイムかつ非侵襲的に調べるための強力なツールになりうること、また、BLI を利用すれば、腫瘍量の増加に必ず伴うとも限らない臨床症状のみに依存する必要がなくなることが結論として言えます。
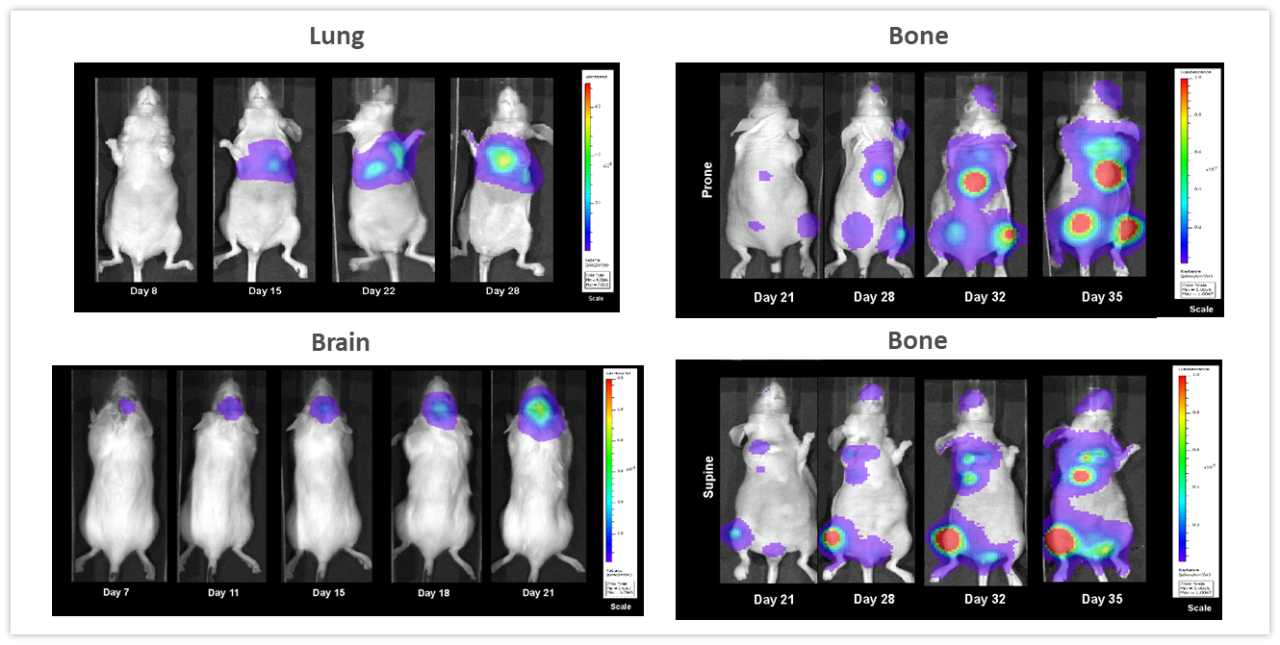
図 2:複数の In vivo モデルによる BLI の典型的な画像。左上は、ヒト肺癌 NCI-H460-Luc2 細胞をメスのヌードマウスの左肺に同所移植したもの。左下は、同系マウス神経膠腫 GL261-luc2 細胞をメスのアルビノ C57BL/6 マウスの脳に同所移植したモデル。右側は、ヒト乳腺腫瘍 MDA-MB-231-luc-D3H2LN をメスのヌードマウスの心臓内に注入した後の全身の骨転移(上が伏臥位、下が仰臥位)。
悪性血液疾患の画像化
With over 80 unique hematological malignancy cell lines, we lead the industry with market-relevant hematologic malignancy models, particularly pertinent in the adoptive cell therapy (ACT), also known as cellular immunotherapy, field.4 BLI is critically valuable when evaluating progression and treatment response in hematological disseminated malignancies. 図 3 は、4 種のヒト血液癌細胞をそれぞれ NSG マウスに静脈注射して長期的経過を調べた時のもので、すべてのモデルで腫瘍量が増加しています。ここでも、病態の進行と重症度を繰り返し評価できることと腫瘍シグナルの体内分布を理解できるという点で、 BLI の価値を見て取ることができます。
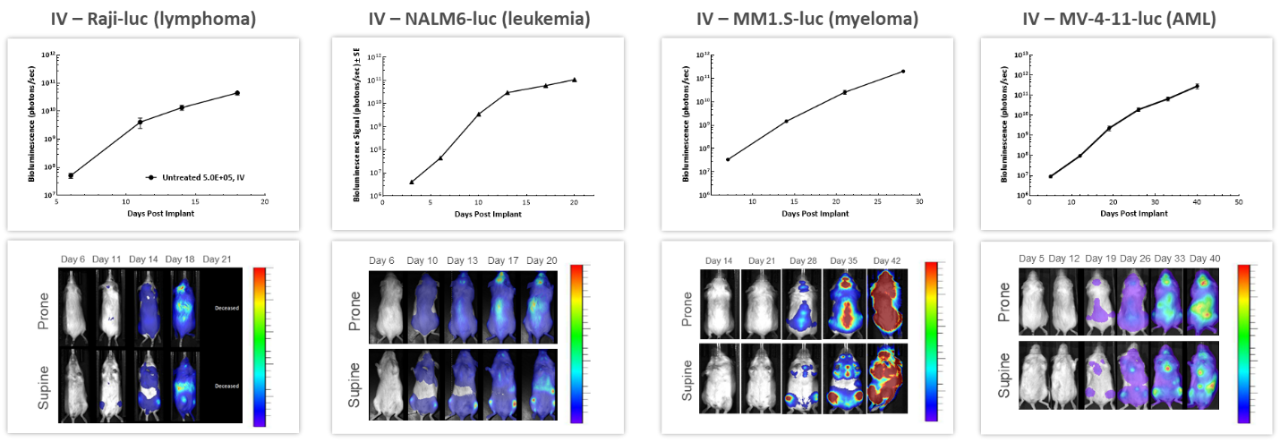
図 3:各種 In vivo ヒト血液悪性腫瘍モデルの NSG マウス静脈注射後の典型的な BLI データ。
ACT は常に進化しつつあり、より効果的かつパーソナライズされたオプションを患者様に提供しています。CAR-T 細胞とは、腫瘍細胞が発現する抗原やマーカーを特に標的とする自家 T 細胞または同種 T 細胞のことです。CAR-T 細胞の有効性と安全性を前臨床の In vivo 試験で評価することは、新しい治療法を臨床入りさせる前の重要な取り組みでもあります。 図 4 は、ヒト Raji-luc B 細胞リンパ腫細胞を静脈内に移植した NSG マウスを用いてさまざまな CAR-T 細胞製剤とその用量について調べた時のもので、 この研究では 3 つの異なる CAR-T コンストラクトが腫瘍負荷を大幅に抑制し、生存期間を延長しました。このように BLI は、新しい細胞免疫療法の開発においても有意に働いているのです。
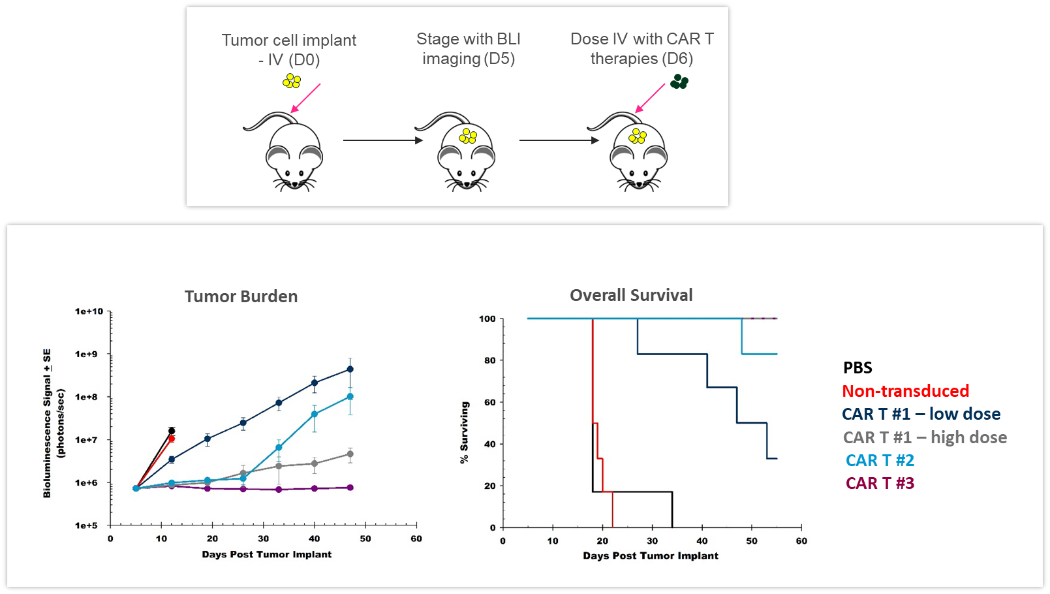
図 4:ヒト Raji-luc B 細胞リンパ腫細胞を静脈内に移植した NSG マウスに対する CAR-T 療法の効果。上は、腫瘍細胞の注入から CAR-T 療法までの流れ。下は、BLI による腫瘍量評価と全生存期間。
治療効果のモニタリング
放射線
明らかに BLI の大きなメリットのひとつは同種動物における抗腫瘍療法の効果を継時的に追跡できることで、それが使用する個体数の削減を可能にします。 図 5 の例では、肺癌の脳転移を模倣するため、メスのヌードマウスに NCI-H1975-luc ヒト非小細胞肺癌を頭蓋内移植し、 そのうえで RadSource 社の放射線照射装置 RS-2000 を用いて 2 セット構成の分割照射 (2Gy を 5 日間照射して 2 日間休むサイクルを 2 回)を行いました。対照群には偽照射を施しています。継時的に取得した BLI 画像を見ると、放射線を照射したグループで腫瘍量が著しく減少し(図 5、19 日目で p<0.05)、生存期間は 160% 延びています(p<0.05、図なし)。この実験では治療の反応を In vivo で定量化することができました。治療反応の定量化は、効果のモニタリングという点だけでなく、新しい治療アプローチをデザイン、改良するうえでも重要です。
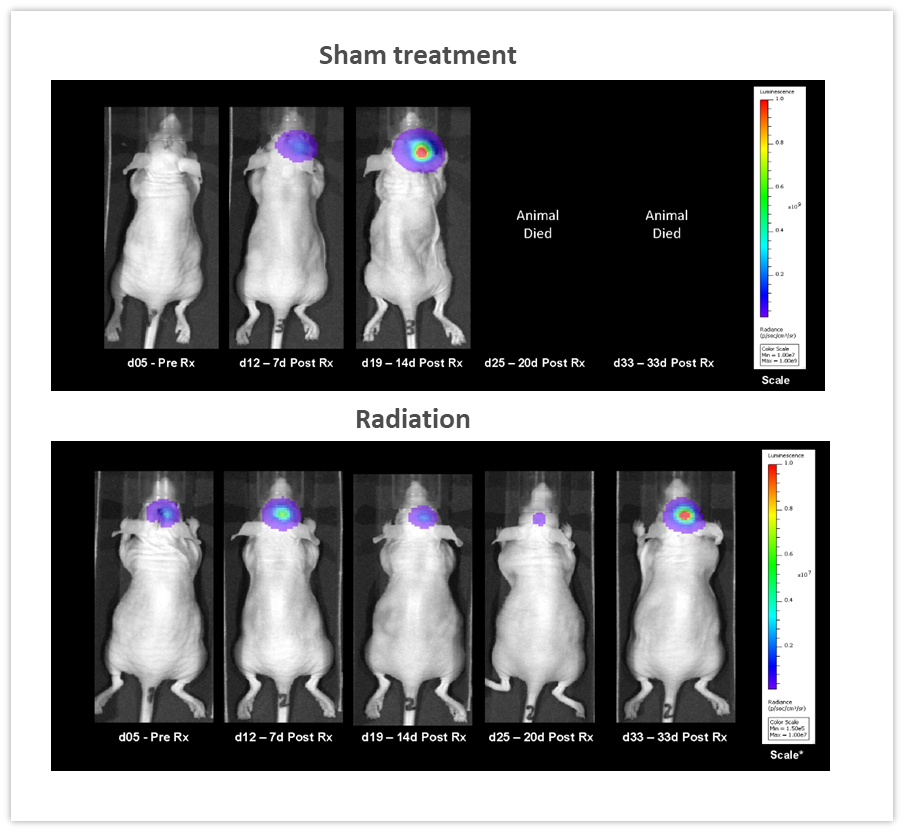
図 5:NCI-H1975-luc ヒト非小細胞肺癌を頭蓋内移植したヌードマウス(メス)に対する放射線局所照射治療(2Gy を 5 日間照射して 2 日間休むサイクルを 2 回) の効果
チェックポイント阻害剤とその併用療法
私たちは、マウス同系 GL261-luc2 神経膠腫細胞をメスのアルビノ C57BL/6 マウスに頭蓋内移植したモデルを使用して、チェックポイント阻害剤の単独投与と、放射線との併用療法の効果を調べました。マウスは、無治療のグループと、小動物放射線研究プラットフォーム(SARRP、Xstrahl Inc.)で 7.5Gy の放射線単回照射を行うグループ、抗マウス PD-1抗体(クローン RMP1-14、10 mg/kg)を投与するグループ、放射線照射と抗体投与を併用するグループに分かれています。図 6(左)が示している通り、腫瘍細胞移植から 6 日後の時点ですでに BLI のシグナルが現れており、その後数週間かけて増殖が広がっています。生物発光シグナルを定量化したものが右の図で、腫瘍量から見た治療の効果を示しています。抗 mPD-1 治療を行ったグループでは、腫瘍の増殖速度が 2.6 日分鈍化し、全体の 1/8 が無腫瘍で生き残り(TFS)ました。一方、放射線治療を施したグループは腫瘍増殖速度が 16.6 日分鈍化し、無腫瘍で生存(TFS)したマウスは 全体の 2/8 となっています。放射線と抗 mPD-1 抗体を併用したグループでは、腫瘍増殖速度が 38.6 日分と大幅に鈍化し、全体の 7/8 が完全寛解しました。従来、体内の深部にある腫瘍の治療反応を測定するのは最終時点で、多くの場合、その作業には多大な時間がかかります。 このように、コーヴァンスでは In vivo BLI イメージングを研究に組み込むことで、これまでブラックボックス化していた腫瘍治療の反応の一つひとつをリアルタイムで評価できるようになりました。そこから治療法をよりスピーディに調整・改良するための柔軟性も生まれています。
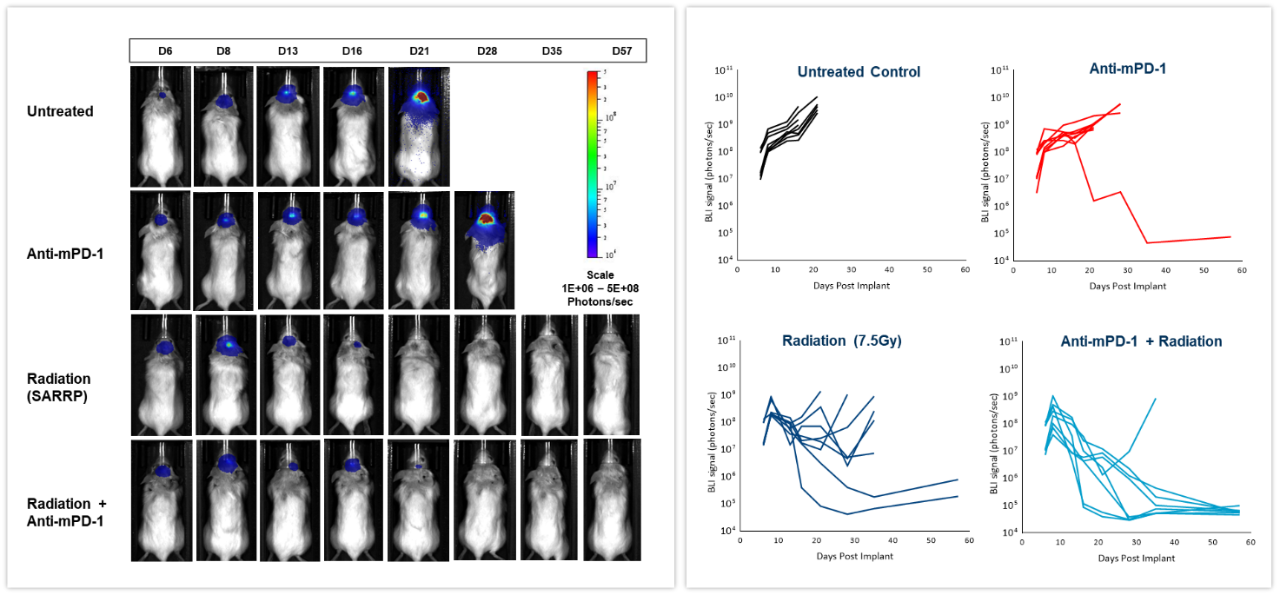
図 6: メス C57BL/6 アルビノマウス頭蓋内 GL261-luc 腫瘍モデルにおける放射線焦点放射、抗 mPD-1 抗体投与、放射線・抗体併用の効果。
マルチモダリティ(複数の手法の組み合わせ)
BLI は、他の画像化手法と組み合わせてさまざまな生物学的経路を調べることができます。 私たちはこれを実践して説明するため、免疫力のある BALB/c マウスの乳房脂肪体に 4T1-luc2-1A4 マウス乳腺癌細胞を同所注入移植したモデルを使用し、 腫瘍が ~300 mm3 に達したところで近赤外線造影剤 ProSenseTM750 を静脈注射して、乳癌の進行に伴うカテプシンの活性を調べました。ProSenseTM750 は、カテプシンに切断されると蛍光を発する光学的に無音の薬剤です。図 7 を見ると分かりますが、BLI と FLI のシグナルが腫瘍部で発光しているのが容易に確認できます。しかし、BLI と FLI のシグナルは完全には一致していません。これはおそらく、ルシフェラーゼが生細胞で産生されるのに対し、蛍光シグナルでは腫瘍細胞だけでなくその他の腫瘍関連細胞も可視化されているのが原因で、その主なものであるマクロファージはカテプシン ProSenseTM750 プローブの切断と取り込みを司っています。 Multimodality can thus be used to interrogate different biologies in vivo, simultaneously.
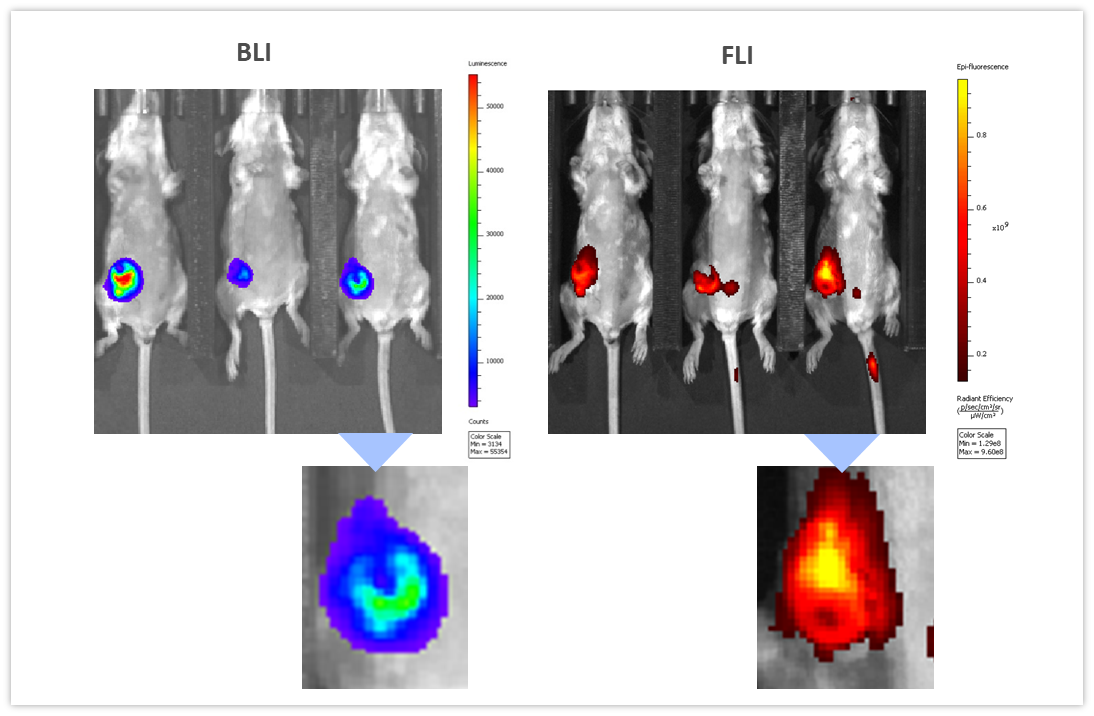
図 7:カテプシン特異的 ProSenseTM750 蛍光プローブを静脈注射し、24 時間後に 4T1-luc2-1A4 腫瘍をマルチモダリティで画像化した。左が BLI で右が FLI。下段は同じ腫瘍を拡大したもの。
まとめ
組織深部の癌や癌転移のマウスモデルによる研究は、組織の重量や結節数をはじめ、腫瘍量などの組織学的分析に大きく依存しています。BLI は 20 年以上前に導入されて以来、生物発光タグで標識された癌細胞株の増殖動態を、継時的に、あるいは各種治療法の反応として In vivo で追跡するための貴重な技術となりました。BLI では同じ被験体を継時的に画像化できるため、試験に使用する動物個体数が少なくて済むほか、最終評価を行う必要もありません。こうして BLI は、確立された侵襲性の画像化手法や放射性同位体に依存する非侵襲性手法の代替手段としての役割を果たしながら、さまざまな科学分野で大きな貢献をしてきました。
Contact the scientists to request the full data set or to learn more about our BLI service and how it can be applied to your preclinical research.
参照
1Contag CH, Spilman SD, Contag PR, Oshiro M, Eames B, Dennery P, Stevenson DK, Benaron DA. Visualizing gene expression in living mammals using a bioluminescent reporter(生物発光レポーターによる、生きている哺乳類の遺伝子発現の可視化) Photochem Photobiol 1997; 66: 523–531.
2de Wet JR, Wood KV, Helinski DR, DeLuca M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli(ホタルルシフェラーゼ cDNA のクローニングと大腸菌における活性ルシフェラーゼの発現) Proc. Natl. Acad. Sci. U.S.A. 1985; 82, 7870–7873.
3 Jenkins DE, Oei Y, Hornig YS, Yu SF, Dusich J, Purchio T, Contag PR. Bioluminescent imaging (BLI) to improve and refine traditional murine models of tumor growth and metastasis(従来の腫瘍成長・転移マウスモデルを改善・改良する生物発光イメージング(BLI)) Clin Exp Metastasis, 2003; 20(8):733-744.
4 https://www.cancerresearch.org/immunotherapy/treatment-types/adoptive-cell-therapy
お問い合わせはこちら
お問い合わせ