Date: October 2020
With the development of increasingly complex immunotherapies, biotech/pharma companies are now looking for more relevant and accurate preclinical tumor models to predict precise drug responses.
前臨床のオンコロジー研究は、動物の体を使って人間の病気を模擬的に再現することを目的としていますが、研究者が直面している最大の課題は、その結果が橋渡しできるものであるかどうかです。理想的な前臨床腫瘍モデルとなるためには、特定のサブタイプの癌を持っているだけでなく、腫瘍を形成する複雑な微小環境もシミュレーションできなければなりません。
腫瘍の移植部位によって、腫瘍の動態、血管新生、構造、低酸素環境、抗腫瘍治療に対する感度などの重要なパラメータに影響が及び得ることが、最近の複数の出版物に示されています1-4。
比較的よく用いられる皮下(SC)モデルには、腫瘍の大きさをキャリパーで測定してモニタリングできるというメリットがありますが、 SC モデルの形態、血管密度、免疫細胞の浸潤、腫瘍の微小環境は、内臓腫瘍のものとは異なります。 これはまさに腫瘍細胞株や患者様由来の異種移植片を組織タイプの同じ臓器に移植する同所性(OT)の腫瘍モデルが捉えている点で、
ある状況における免疫療法ではOT 腫瘍モデルが免疫抑制性で大量のマクロファージを有し、特定の免疫療法に対する感受性が皮下移植した同じモデルよりも低くなり得ることが、公開されているデータによって示されています2。
OT モデルが原発巣として機能しながら SC モデルよりも関連性の高い腫瘍微小環境を提供する可能性があるかを調べるため、私たちは複数の同系細胞株にルシフェラーゼを組み込んで腫瘍の増殖と転移を非侵襲的にモニタリングしました。
この「モデルスポットライト」では、マウス膵臓腺癌の細胞株 Pan02-Luc のモデル開発をご紹介します。注:動物を用いた作業はすべて、施設を管轄する動物実験委員会によって承認されており、「Guide for the Care and Use of Laboratory Animals」(実験動物の管理と使用に関する指針)に従って AAALAC 認定プログラムの範囲内で実施されています。体重と所定の臨床所見に基づいて人道的安楽死の基準もあらかじめ設定されています。
Pan02-Luc のモデル開発:マウス膵臓腺癌細胞株
まず、C57BL/6 マウスの膵臓(膵頭部)に Pan02-Luc 細胞を外科的に移植し、生物発光イメージング(BLI)で測定したところ、~100% の割合で腫瘍が形成され、それが平均約 6 日の倍加速度で安定的に成長しました。このモデルは平均生存期間(死亡するまで)が 58 日と比較的長かったため、5〜6 週間投与を行って有効性を評価することができました(図 1)。腫瘍の生着と増殖が体重に悪影響を及ぼすことはなく、安楽死に至った臨床所見として最も多かったのは腹部膨満でした(データ掲載なし)。
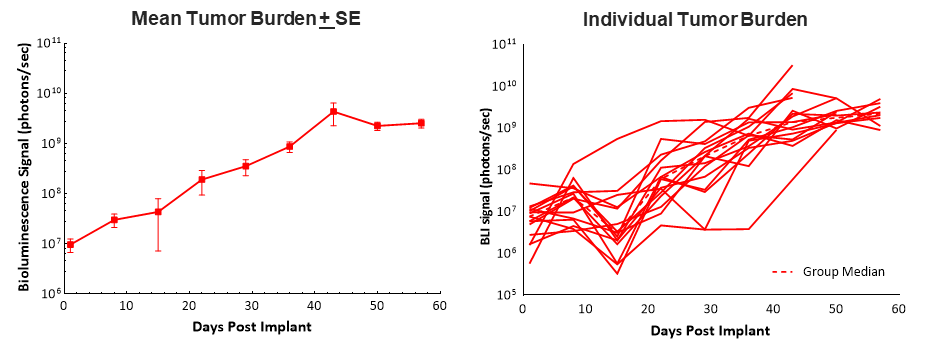
膵臓癌は「冷たい」腫瘍と見なされ、免疫療法にそれほど反応しないことがよく知られています。そのため私たちは、チェックポイント阻害剤の抗mPD-1 のみを、ゲムシタビンと合わせて調べました。
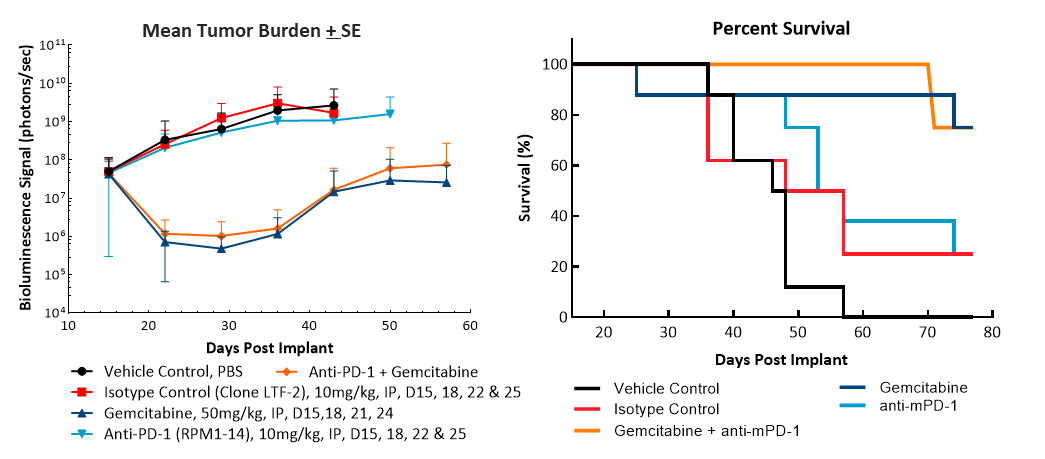
最初に抗 mPD-1(10mg/kg)で治療を行ったところ、特に有意な反応はなく(図 2)、 次に、臨床的関連性の高い、標準治療として用いられる化学療法薬ゲムシタビン(50mg/kg)で治療をすると、腫瘍の完全退縮(CR) 87%(7/8)(全個体数に占める割合)、無腫瘍生存(TFS) 62% (5/8) という判定結果が BLI イメージングで得られました。治療終了後に腫瘍の再増殖が観察されたのは 2 個体でした。さらにゲムシタビンと抗 mPD-1 を併用して治療を行いましたが、TFS がゲムシタビン単独療法時の値を上回ることはありませんでした。図 2C(生物発光イメージング) と図 2D(組織像)はそれぞれの実験の最後に撮影した画像の代表的なもので、ゲムシタビンで治療したグループの腫瘍が退縮しているのがわかります。
図 2. 抗 mPD-1 とゲムシタビンでの治療に対する Pan02-Luc の反応

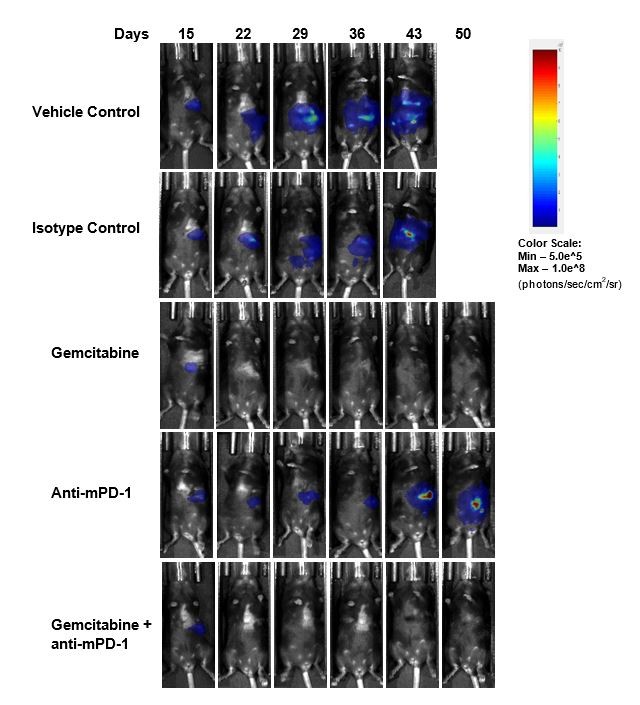
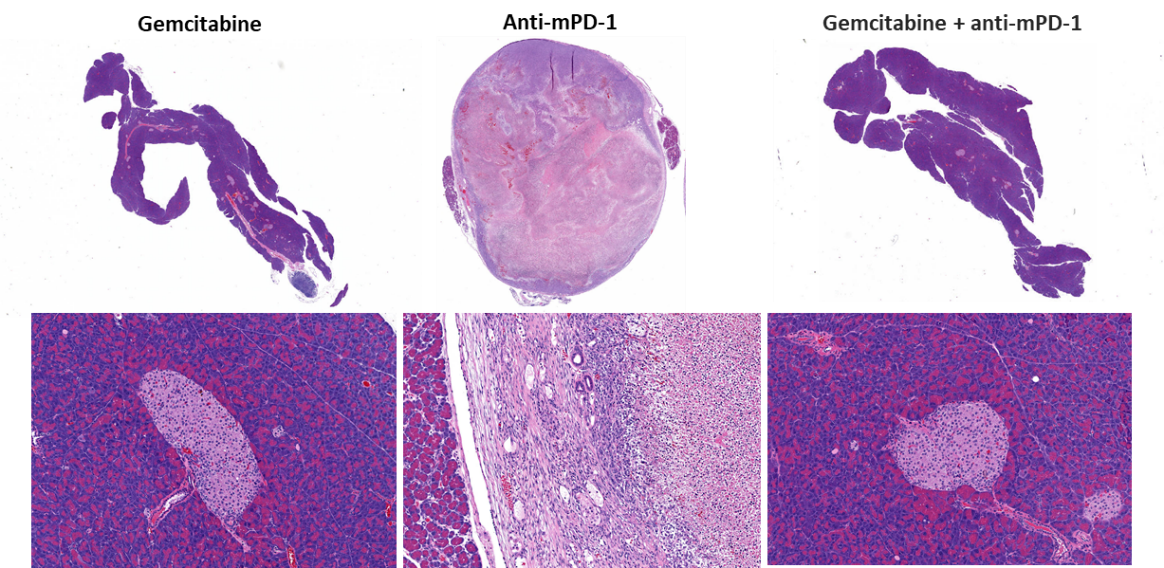
以前、皮下(SC) Pan02 モデルの免疫療法に対する反応についてお伝えしました(注目のモデルに関するこちらのページをご覧ください)。以上、Luc を組み込んだ Pan02 細胞株 OT モデルのデータを、SC 親 Pan02 モデルのもの比べると、抗 mPD-1 に対する反応は互いに類似していることが分かりました。ゲムシタビンについては、同じ濃度で投与した場合、反応は SC モデルよりも OT モデルがはるかに大きく、OT では増殖速度が低下し、PR(部分退縮)は 80%、CR は 20%、TFS はゼロとなりました(図 1)。
表 1. ゲムシタビン治療に対する Pan02 の腫瘍反応 - SC モデルと OT モデルの比較
また、免疫細胞の OT 腫瘍への浸潤をフローサイトメトリーで調べたところ、非免疫原性、いわゆる「冷たい」腫瘍モデルの特徴であるリンパ系細胞の浸潤不良が確認されました(図 3A-B)。というのは、CD8+ と CD4+ ヘルパー T 細胞の割合が CD45+ 細胞集団全体に対してそれぞれ 1.6% 、1% とわずかだったのです。それに対し、免疫抑制性骨髄細胞集団である単球性骨髄由来サプレッサー細胞集団(M-MDSC) と M1 / M2 腫瘍関連マクロファージ(TAM)は豊富に存在し、細胞亜集団を支配していました。OT モデルと SC モデルの免疫プロファイルを比較すると、OT の腫瘍では、制御性 T 細胞(Treg)、ナチュラルキラー細胞(NK)、ナチュラルキラー T 細胞(NKT)が著しく減少していました。概して、骨髄性細胞の量は OT モデルの方が多く、CD45+細胞の全体に占める割合は最大 82%(SC モデルでは最大 68%)となっています。OT モデルの腫瘍は、顆粒球型 MDSC と M2-TAM の細胞量が圧倒的に多い一方、樹状細胞は少なく、より抗炎症性の免疫抑制表現型を示していました。
図 3. フローサイトメトリーによる SC / OT モデルの腫瘍分析
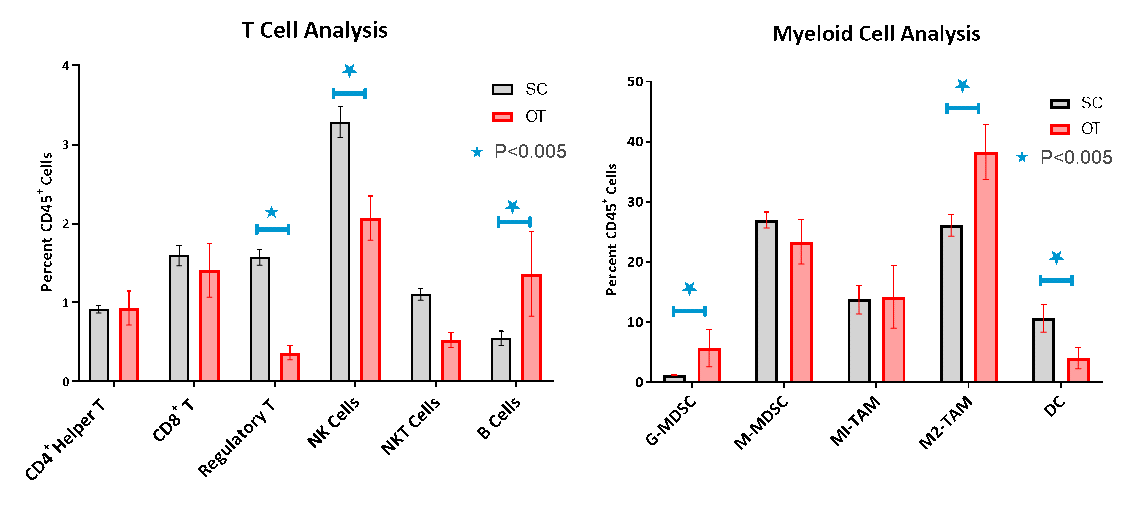
こうして知り得た SC モデルと OT モデルの微妙な違いは、私たちが研究している治療法の反応について洞察を提供してくれるかもしれません。双方の違いは、膵臓癌患者様の反応と予後の予測可能性に影響を与えることから臨床的に重要であることも報告されています5-7。
腫瘍の同所移植を用いると、臨床のシナリオをよりうまく模擬的に再現して、癌の進行や薬物反応をモデリングすることができます。臓器とその微小環境はそれぞれ固有のものであるため皮下移植では再現できず、したがって可能な場合は同所モデルを使用することが大切です。
At preclinical oncology, we offer several luciferase-enabled models for this purpose.
このモデルの詳細をご希望の場合は、当社までお問い合わせください。
参照
1. Erstad DJ, et al., 2018. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy(膵臓癌の同所・異所マウスモデル、およびそのそれぞれに異なる FOLFIRINOX 化学療法への反応). Dis Model Mech., 7月 1; 11(7): dmm034793
2. Devaud C, et al., 2014. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy(さまざまな解剖学的部位の組織が、腫瘍の微小環境を形成し変化させて、治療への反応に影響を与え得る). Mol Ther., 1月 22(1):18-27
3. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020. Preclinical murine tumor models: a structural and functional perspective(前臨床マウス腫瘍モデル:構造および機能に関する考察). eLife., 2020;9:e50740
4. Qui W and Su GH. 2013. Development of orthotopic pancreatic tumor mouse models(同所性膵臓腫瘍マウスモデルの開発). Methods Mol Biol., 980:215-223
5. Kurahara H, et al., 2011. Significance of M2-polarized tumor-associated macrophage in pancreatic cancer(膵臓癌における M2 極性化腫瘍関連マクロファージの重要性). J Surg Res., 5月 15; 167(2):e211-e219
6. Parente P, et al., 2018. Crosstalk between the tumor microenvironment and immune system in pancreatic ductal adenocarcinoma: Potential targets for new therapeutic approaches(膵管腺癌の腫瘍微小環境-免疫系間のクロストーク:新しい治療アプローチの潜在的標的). Gastroenterology Res and Practice. 2018:7530619
7. Lankadasari M, et al., 2019. TAMing pancreatic cancer: combat with a double-edged sword(TAM の集積しつつある膵臓癌:両刃の剣で戦いに挑む). Mol Cancer 18:48
お問い合わせはこちら
お問い合わせ